Gli alcani sono idrocarburi che presentano solo legami singoli tra gli atomi di carbonio. Sapendo questo e ricordando che gli idrocarburi sono costituiti solo da carbonio e idrogeno, si può dare la formula generale di un alcano non ciclico: CnH2n+2; gli alcani ciclici (cioè con una catena chiusa in sé stessa) hanno come formula generale CnH2n
Questo significa che un alcano che ha un numero n di atomi di carbonio ha un numero di atomi di idrogeno pari al doppio più 2. Le formule di struttura dei più semplici alcani lo mostrano facilmente:
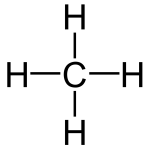


La nomenclatura base degli alcani, come degli altri idrocarburi semplici, la abbiamo vista nella lezione precedente, ricapitolando: suffisso -ano, prefisso in base agli atomi di carbonio (i primi quattro termini met-, et-, but-, prop-, da 5 in poi i “classici” pent-, es-, ept- ecc.).
Gli idrocarburi, però, possono anche avere ramificazioni, cioè a uno o più atomi di carbonio della molecola, oltre a idrogeni, possono legarsi ulteriori catene di carbonio. In questo caso la nomenclatura deve tenerne conto e diventa più complessa.
Quando ci si trova di fronte a un alcano (e più in generale a un idrocarburo) ramificato per dargli un nome si seguono queste regole:
- Identificazione catena principale, che è quella più lunga
- Dal numero di C della catena più lunga si prende il prefisso: ad esempio, se la catena più lunga ha 5 atomi di carbonio, avremo innanzitutto un pentano
- Si dà un numero agli atomi di carbonio della catena più lunga iniziando la numerazione dal lato dove si incontra per prima una ramificazione
- Si trovano i nomi delle ramificazioni, sempre in base a quanti atomi di carbonio posseggono
- Il nome della molecola è quindi dato da:
[numero C della catena principale a cui è legata la ramificazione]-[nome ramificazione] [nome catena principale] - Se ci sono più ramificazioni, queste vengono elencate in ordine alfabetico, non in base a dove si attaccano alla catena principale. Quindi, se avessimo un etano attaccato in posizione 2 e un butano in posizione 3, la molecola si chiamerà 3-butano 2-etano, e non viceversa.
- Se ci sono più ramificazioni con lo stesso nome, ad esempio un butano in posizione 2 e anche in posizione 4, questi vanno insieme come 2,4-dibutano
- Se l’alcano è ciclico, il nome è preceduto dal prefisso ciclo-
Di seguito alcuni esempi, prova a dargli un nome prima di leggere la didascalia:


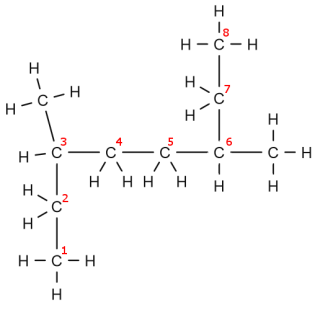
Proprietà fisiche
Gli alcani sono insolubili in acqua, essendo molecole apolari, mentre sono solubili in solventi apolari. A temperatura ambiente (20 °C, 293 K) si trovano in forma gassosa fino al butano, in forma liquida fino all’esadecano, solidi con numero di atomi di carbonio maggiore.
Sono privi di odore e di colore. Quello che è detto “odore di gas” che si sente in presenza, ad esempio, di metano e GPL, è in realtà dovuto a composti aggiunti proprio per segnalare la presenza di questi gas.
Con l’aumentare degli atomi di carbonio il punto di ebollizione sale notevolmente, soprattutto a causa delle interazioni intramolecolari (soprattutto forze di van der Waals). Le temperature di liquefazione seguono un andamento simile.
Proprietà chimiche
Gli alcani sono scarsamente reattivi. Le reazioni principali avvengono con alogeni e composti polari.
In presenza di ossigeno ed alte temperature si ha la combustione, che trasforma l’alcano e l’ossigeno in acqua e anidride carbonica o monossido di carbonio, a seconda della sufficiente presenza di ossigeno o meno. La reazione generale è:
- combustione completa: CnH2n+2 + ( 3⁄2n + 1⁄2) O2 → (n + 1) H2O + n CO2
- combustione incompleta: CnH2n+2 + (n + 1⁄2) O2 → (n + 1) H2O + n CO
Ad esempio, la combustione del metano:
- combustione incompleta: CH4 + 2 O2 → CO2 + 2 H2O
- combustione incompleta: 2 CH4 + 3 O2 → 2 CO + 4 H2O
In presenza di radicali liberi di alogeni si ha l’alogenazione. La reazione inizia con un alogeno in forma molecolare, ad esempio Cl2 o Br2, che viene spezzato da luce e/o alte energie in due radicali liberi. Questi poi aggrediscono l’alcano sostituendosi a un idrogeno. È molto più probabile che vengano attaccati gli idrogeni interni alla molecola piuttosto che quelli alle estremità, dato che il composto che si forma è più stabile quando l’alogeno è interno. Un esempio:
- rottura e formazione del radicale: Cl2 → Cl· + ·Cl
- alogenazione: 2 Cl· + CH3CH2CH3 → CH3CHClCH3 + HCl